.Stanford Scientists Discover Common Genetic Factor That Fends Off Alzheimer’s and Parkinson’s
http://blog.naver.com/mssoms
http://jl0620.blogspot.com
https://www.facebook.com/junggoo.lee.9
.Stanford Scientists Discover Common Genetic Factor That Fends Off Alzheimer’s and Parkinson’s
스탠포드 과학자들이 알츠하이머병과 파킨슨병을 예방하는 공통 유전적 요인을 발견했습니다

주제:알츠하이머병뇌유전학파킨슨병스탠포드 대학교 작성 STANFORD MEDICINE 2023년 12월 10일 인간 두뇌 유전학의 진화
-스탠포드 의과대학 연구진과 국제 동료들은 약 20%의 사람들이 알츠하이머병과 파킨슨병의 위험을 10% 이상 감소시키는 유전자 변이를 가지고 있다는 사실을 발견했습니다. DR4로 알려진 이 변종은 잠재적으로 이러한 신경퇴행성 질환에 대한 미래 백신의 효능을 향상시킬 수 있습니다. 광범위한 글로벌 데이터 분석을 포함하는 이 연구는 또한 타우 단백질과 두 질병 사이의 연관성을 제시하여 표적 치료법과 백신에 대한 새로운 길을 열었습니다. 의학 및 유전 정보에 대한 대규모 분석 결과, 면역 기능과 관련된 유전자의 특정 변종을 보유한 개인은 알츠하이머병 발병 위험이 감소하는 것으로 나타났습니다.
-대략 5명 중 1명은 알츠하이머병과 파킨슨병 모두에 대한 저항성을 제공하는 것으로 보이는 특정 유전자 변이를 보유하고 있습니다. Stanford Medicine 연구원과 협력자들이 발견한 이 발견은 이러한 개인들이 이러한 일반적인 신경퇴행성 질환을 늦추거나 멈추는 것을 목표로 하는 미래 백신의 혜택을 특히 누릴 수 있음을 시사합니다. 여러 대륙의 다양한 조상을 가진 수십만 명의 의료 및 유전 데이터를 분석한 결과, 이 유전자 버전 또는 대립 유전자를 보유하면 파킨슨병이나 알츠하이머병에 걸릴 확률이 평균 10% 이상 감소하는 것으로 나타났습니다.
증거에 따르면 알츠하이머병 환자의 뇌에서 응집되는 것으로 악명 높은 타우(tau)라는 단백질이 어떤 신비한 방식으로 파킨슨병 발병에도 관여할 수 있음이 시사됩니다. 연구 결과와 시사점은 최근 Proceedings of the National Academy of Sciences에 발표된 논문에 설명되어 있습니다. 수면의학 Craig Reynolds 교수이자 정신의학 및 행동과학 교수인 Emmanuel Mignot 박사는 Iqbal Farrukh 및 Asad Jamal 교수이자 신경학 및 신경과학 교수인 Michael Greicius, MD와 선임 저자입니다. , 프랑스 릴 대학교 Inserm 연구 책임자 Jean-Charles Lambert 박사. 주요 저자는 스탠포드 의과대학 정량과학부 컴퓨터 생물학 조교수인 Yann Le Guen 박사입니다. Guo Luo 박사, 수면의학 강사; 전 박사후 연구원 Aditya Ambati, Ph.D.; Lambert 그룹과 관련된 생물정보학자인 Vincent Damotte 박사. 연구에서 확인된 보호 대립유전자는 DR4라고 불립니다.
-"이전 연구에서 우리는 DR4 대립유전자를 보유하는 것이 파킨슨병을 예방하는 것으로 보인다는 것을 발견했습니다"라고 Mignot은 말했습니다. "이제 우리는 알츠하이머병에 대한 DR4의 유사한 영향을 발견했습니다." Stanford Medicine 팀은 유럽, 동아시아, 중동, 남미 및 북미 등 다양한 국가에서 수집한 수십 개의 의료 및 유전자 데이터베이스를 결합했습니다.
-전체적으로 데이터베이스에는 100,000명 이상의 알츠하이머병 환자와 40,000명 이상의 파킨슨병 환자가 포함되어 있습니다. 과학자들은 DR4가 있는 사람들과 그렇지 않은 사람들 사이에서 알츠하이머병과 파킨슨병의 발병률과 발병 연령을 대조한 결과 DR4를 보유한 사람들의 위험이 대략 10% 감소한다는 사실을 발견했습니다. "파킨슨병에 대한 이러한 보호 요인이 알츠하이머병과 동일한 보호 효과를 갖게 되었다는 사실이 저를 당황하게 했습니다"라고 Mignot은 말했습니다. “그 사실을 알게 된 다음날 밤, 저는 잠을 이룰 수 없었습니다.” 연구자들은 또한 7,000명 이상의 알츠하이머 환자의 뇌를 부검한 데이터를 분석한 결과, DR4 운반체가 알츠하이머병을 특징으로 하는 주로 타우로 구성된 긴 필라멘트 집합체인 신경원섬유 엉킴이 적고 증상이 늦게 나타나는 것을 발견했습니다. DR4가 아닌 대응물. 신경원섬유엉킴의 존재는 질환의 중증도와 강한 상관관계가 있는 것으로 나타났습니다.
DR4 보유는 파킨슨병 환자의 증상이 나중에 시작되는 것과도 상관관계가 있었습니다. 비록 신경원섬유엉킴이 해당 질병에서 일반적으로 나타나지 않음에도 불구하고 말이죠. 이 연구는 알츠하이머병의 필수 요소인 타우가 파킨슨병에서도 어떤 역할을 하는 것으로 밝혀질 수 있음을 암시하지만 그 역할이 무엇인지는 명확하지 않다고 Mignot은 말했습니다.
세포의 표면은 세포의 표시창이다 DR4는 DRB1이라는 유전자의 풍부한 대립 유전자 중 하나입니다. DRB1은 인간 림프구 항원 복합체(HLA)라고 불리는 대규모 유전자 복합체의 많은 유전자 중 하나입니다. 이 유전자는 세포의 내부 내용물을 면역 체계에 표시하는 데 중요합니다. 세포의 외막은 세포의 내부를 내부로, 외부를 외부로 유지합니다. 하지만 그게 전부는 아닙니다. 또한 내부의 단백질 조각을 면역체계에 노출시키는 디스플레이 창 역할도 합니다.
세포 표면(외막)에 이러한 단편 또는 펩타이드(잘게 잘린 단백질의 독립형 조각)가 일상적으로 노출되면 이동하는 면역 세포가 이를 정독할 수 있습니다. 세포 표면의 펩타이드를 검사함으로써 순찰하는 면역 세포는 내부에서 이상한 일이 벌어지고 있는지, 즉 감염이나 암 상태를 암시하는 외부 단백질이나 변경된 단백질이 세포에 존재할 수 있는지 여부를 확인할 수 있습니다.
이러한 윈도우 쇼핑을 촉진하는 것은 이러한 모든 펩타이드를 붙잡고 감싸서 면역 인식에 최적인 방식으로 세포 표면에 표시할 수 있는 특수 단백질입니다. 이러한 특수 단백질은 HLA 유전자의 산물입니다. 수많은 HLA 유전자 각각은 매우 다양한 대립유전자로 나타납니다. 우리 각자는 이러한 대립 유전자의 서로 다른 집합을 물려받습니다. 서로 다른 HLA 대립유전자의 단백질 산물이 서로 다른 펩타이드 세트에 결합하기 때문에 개인의 세포가 면역 감시를 위해 표시하는 펩타이드의 종류는 사람마다 다릅니다. 면역 체계가 이전에 본 적이 없다고 생각하는 표면 펩타이드를 발견하면 표면에 해당 펩타이드를 표시하는 모든 세포에 강력한 공격을 가할 수 있습니다. 때로는 판결이 신원 오류로 판명되는 경우도 있습니다. 자가면역이 바로 그런 현상이다.
Mignot은 DR4가 소위 "보호적 자가면역"에 관여한다고 생각합니다. DR4가 붙잡고 표시하는 방법을 알고 있는 특정 펩타이드는 실제로 우리 세포가 만드는 정상적인 단백질인 타우의 화학적으로 변형된 부분입니다. 문제를 일으키는 것은 화학적 변형입니다. 타우 연결? 알츠하이머병과 파킨슨병 모두에서 타우 수준과 병리에 대한 DR4의 유익한 효과에 주목하여 연구자들은 타우에 초점을 맞췄습니다.
그들은 단백질 분자를 타우의 전체 서열에 걸쳐 총 482개의 펩타이드로 잘게 자른 다음 이를 DR4의 단백질 제품(DR4라고도 함)과 함께 별도의 접시에 넣어 해당 펩타이드 중 하나에 강하게 결합하는지 확인했습니다. 또한 연구자들은 각 펩타이드가 세포 내부에서 생성된 후 발생할 수 있는 생물학적으로 가능성이 있는 모든 화학적 변형을 테스트했습니다. DR4는 단일 펩타이드에 특히 강력한 그립을 발휘했습니다.
PHF6라고 불리는 타우 단백질의 이 부분은 아세틸화(해당 부분의 단백질 구성 요소 중 하나에 작은 화학적 덩어리가 부착되는 것)라는 변화에 의해 알츠하이머 환자의 뇌에서 자주 변경됩니다. 아세틸화된 PHF6은 이미 타우 분자가 신경원섬유 엉킴으로 응집되는 경향과 관련이 있습니다. "강하게 결합된 DR4의 유일한 펩타이드는 PHF6이었고, 이 펩타이드가 아세틸화되었을 때만 가능했습니다."라고 Mignot은 말했습니다.
PHF6 아세틸화가 신경원섬유 엉킴으로의 타우 응집을 촉진한다는 것은 이미 알려져 있다고 그는 지적했습니다. 아세틸화는 면역체계를 속여 PHF6가 외부인이자 위협이라고 생각하도록 "속여서" 면역체계가 초기 신경원섬유 엉킴을 공격하고 파괴하도록 유도할 수 있다고 Mignot은 말했습니다. 그는 아세틸화된 PHF6으로 구성된 백신을 만들어 DR4를 보유하고 있는 사람들에게 DR4가 더 효과적으로 작용하도록 하는 것이 가능할 수 있다고 생각합니다.
이 변형된 펩타이드에 면역체계의 주의를 끌 때 이러한 백신은 타우의 응집을 방해할 수 있습니다. DR4의 보호 변종 중 하나라도 보유하고(모두가 보호하는 것은 아님) 뇌에 타우 응집체가 축적되기 시작한 사람들의 경우 백신이 알츠하이머병 및 파킨슨병의 발병을 지연시키거나 진행을 늦출 수 있다고 Mignot은 제안했습니다. DR4를 보유하지 않은 사람들은 이 백신의 혜택을 받지 못할 것이라고 Mignot은 지적했습니다.
더욱이 DR4는 유전적 서열의 미세한 차이로 구별되는 다양한 하위 유형으로 분류됩니다. DR4의 6~7가지 가장 일반적인 하위 유형 중 하나는 한 조상의 사람들에게 더 흔할 수 있는 반면, 다른 유형은 다른 조상의 사람들에게 더 우세할 수 있습니다. 예를 들어, 동아시아인에게 가장 흔한 DR4 하위 유형은 다른 인구 집단에서 가장 흔한 DR4 하위 유형만큼 신경퇴행성 질환을 예방하는 데 도움이 되지 않는 것 같습니다. 누가 백신을 접종해야 하는지, 접종하지 말아야 하는지 알아보기 위해 혈액 검사를 받아야 한다고 Mignot은 말했습니다.
참고 자료: "알츠하이머병 및 파킨슨병의 HLA 유전자좌에 대한 다계통 분석에서는 HLA-DRB1*04에 의해 매개되는 공유 적응 면역 반응이 밝혀졌습니다.
==============================
메모 2312111618 나의 사고실험 qpeoms 스토리텔링
스탠포드 과학자들이 알츠하이머병과 파킨슨병을 예방하는 공통 유전적 요인을 발견했다. DR4 대립유전자를 보유하는 것이 파킨슨병을 예방하는 것으로 보인다는 것이다.
뇌질환으로 인하여 지적인 인성을 상실하면 인간다운 지적이고 품위있는 qpeoms.human의 고상하고 성숙한 노년의 드라마틱한 마무리 삶을 더이상 유지하기 어렵다.
그래서 인간의 노년을 추악하게 만드는 알츠하이머병과 파킨슨병을 예방하는 공통 유전적 요인을 필사적으로 다각적으로 예측개발하고 뇌질환에 대해 근본적인 퇴치의 매카니즘을 의학적 확보해야 한다. 으음. 인간의 지적인 생물학적인 뇌를 영구히 보존하여 우주의 여러 곳에 번식 시켜야 한다. 허허.

-Researchers at Stanford University School of Medicine and their international colleagues found that about 20% of people carry a genetic variant that reduces the risk of Alzheimer's disease and Parkinson's disease by more than 10%. This variant, known as DR4, could potentially improve the efficacy of future vaccines against these neurodegenerative diseases. The study, which included extensive global data analysis, also suggested a link between the tau protein and the two diseases, opening new avenues for targeted treatments and vaccines. A large-scale analysis of medical and genetic information has found that individuals who carry certain variants of genes associated with immune function have a reduced risk of developing Alzheimer's disease.
-Approximately one in five people carry a specific genetic mutation that appears to provide resistance to both Alzheimer's disease and Parkinson's disease. This discovery by Stanford Medicine researchers and collaborators suggests that these individuals may particularly benefit from future vaccines aimed at slowing or stopping these common neurodegenerative diseases. An analysis of medical and genetic data from hundreds of thousands of people of diverse ancestry across multiple continents found that carrying this gene version, or allele, reduces the risk of developing Parkinson's or Alzheimer's disease by an average of more than 10%.
-"In previous studies, we found that carrying the DR4 allele appears to be protective against Parkinson's disease," Mignot said. “Now we have discovered a similar effect of DR4 on Alzheimer’s disease.” The Stanford Medicine team combined dozens of medical and genetic databases from countries as diverse as Europe, East Asia, the Middle East, South America, and North America.
============================================
Memo 2312111618 My thought experiment qpeoms storytelling
Stanford scientists have discovered a common genetic factor that protects against Alzheimer's disease and Parkinson's disease. Having the DR4 allele appears to prevent Parkinson's disease.
If one loses one's intellectual character due to a brain disease, it is no longer possible to maintain a noble, mature and dramatic life of an intelligent and dignified qpeoms.human.
Therefore, we desperately need to predict and develop common genetic factors that prevent Alzheimer's disease and Parkinson's disease, which make human old age ugly, and medically secure a fundamental eradication mechanism for brain diseases. Umm. The human intelligent and biological brain must be permanently preserved and propagated in various places in the universe. haha.
Sample oms (standard)
b 0 a c f d 0000e0
0 0 0 a c 0 f00bde
0 c 0 f a b 000e0d
e 0 0 d 0 c 0b0fa0
f 0 0 0 e 0 b0dac0
d 0 f 0 0 0 cae0b0
0 b 0 0 0 f 0ead0c
0 d e b 0 0 ac000f
c e d 0 b a 00f000
a 0 b 0 0 e 0dc0f0
0 a c e 0 0 df000b
0 f 0 0 d 0 e0bc0a
sample qoms (standard)
0000000011=2,0
0000001100
0000001100
0000010010
0001100000
0101000000
0010010000
0100100000
2000000000
0010000001
sample pms (standard)
q0000000000
00q00000000
0000q000000
000000q0000
00000000q00
0000000000q
0q000000000
000q0000000
00000q00000
0000000q000
000000000q0
Sample oss.base (standard)
zxdxybzyz
zxdzxezxz
xxbyyxzz
zybzzfxzy
cadccbcdc
cdbdcbdbb
xzezxdyyx
zxezybzyy
bddbcbdca

.New genes found that can arise 'from nothing' by University of Helsinki
'무(無)로부터' 발생할 수 있는 새로운 유전자 발견
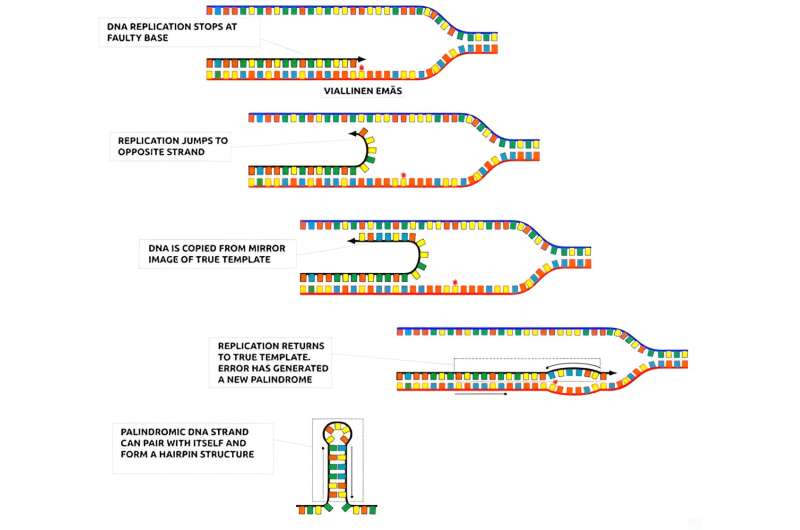
작성자: 헬싱키 대학교 연구자들은 DNA 복제의 오류 메커니즘을 연구한 결과 일부 오류가 헤어핀 구조로 접힐 수 있는 회문을 생성한다는 사실을 발견했습니다. 크레딧: Ari Löytynoja DECEMBER 8, 2023
살아있는 유기체의 복잡성은 유전자 내에 암호화되어 있습니다. 그런데 이 유전자는 어디서 오는 것일까요? 헬싱키 대학의 연구자들은 작은 조절 유전자의 기원에 관한 뛰어난 문제를 해결하고 DNA 회문을 생성하는 메커니즘을 설명했습니다. 적절한 환경에서 이러한 회문은 마이크로RNA 유전자로 진화합니다.
인간 게놈에는 ca. 단백질을 구성하는 데 사용되는 유전자는 20,000개입니다. 이러한 고전적 유전자의 작용은 수천 개의 조절 유전자에 의해 조정되며, 그 중 가장 작은 유전자는 길이가 22개 염기쌍인 microRNA 분자를 암호화합니다. 유전자의 수는 상대적으로 일정하지만 진화 과정에서 새로운 유전자가 나타나는 경우도 있습니다. 생물학적 생명의 기원과 유사하게, 새로운 유전자의 기원은 계속해서 과학자들을 매료시켜 왔습니다.
모든 RNA 분자에는 분자를 기능적 형태로 고정하는 회문형 염기가 필요합니다. 중요한 것은, 단순한 마이크로RNA 유전자의 경우에도 무작위 염기 돌연변이가 점진적으로 이러한 회문형 실행을 형성할 가능성이 극히 적다는 것입니다. 따라서 이러한 회문 시퀀스의 기원은 연구자들을 당황하게 만들었습니다.
-핀란드 헬싱키 대학 생명공학 연구소의 전문가들은 완전한 DNA 회문을 즉시 생성할 수 있는 메커니즘을 설명하고 이전에 코딩되지 않은 DNA 서열에서 새로운 마이크로RNA 유전자를 생성함으로써 이 미스터리를 해결했습니다. 그들의 프로젝트에서 연구자들은 DNA 복제의 오류를 연구했습니다. 프로젝트 리더인 Ari Löytynoja는 DNA 복제를 텍스트 입력에 비교합니다.
DNA는 한 번에 한 염기씩 복사되며, 일반적으로 돌연변이는 노트북 키보드의 잘못된 펀치처럼 잘못된 단일 염기입니다. 우리는 다른 컨텍스트에서 텍스트를 복사하여 붙여넣는 등 더 큰 오류를 생성하는 메커니즘을 연구했습니다. 우리는 특히 텍스트를 거꾸로 복사하여 회문을 만드는 경우에 관심을 가졌습니다.” 연구자들은 DNA 복제 오류가 때때로 유익할 수 있다는 것을 인식했습니다.
그들은 이러한 발견을 RNA 생물학 전문가인 Mikko Frilander에게 설명했습니다. 그는 즉시 RNA 분자 구조와의 연관성을 보았습니다. RNA 분자에서 인접한 회문의 염기는 쌍을 이루어 머리핀과 유사한 구조를 형성할 수 있습니다. 이러한 구조는 RNA 분자의 기능에 매우 중요합니다." 그는 설명한다. 핵심 통찰력은 관련 종의 정보를 사용하여 유전자 이력을 모델링하는 것이었습니다.
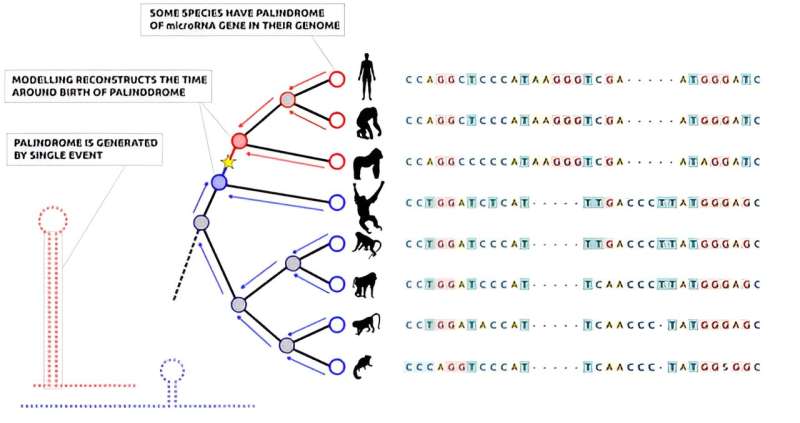
모델링은 마이크로RNA 유전자의 회문이 단일 돌연변이 사건에 의해 생성된다는 것을 입증했습니다. 크레딧: Ari Löytynoja
연구자들은 구조가 단순하기 때문에 microRNA 유전자에 초점을 맞추기로 결정했습니다. 유전자는 수십 개의 염기로 매우 짧으며 올바르게 기능하려면 머리핀 구조로 접혀야 합니다. 핵심 통찰력은 맞춤형 컴퓨터 알고리즘을 사용하여 유전자 이력을 모델링하는 것이었습니다.
박사후 연구원인 헬리 몬티넨(Heli Mönttinen)에 따르면, 이것은 지금까지 유전자의 기원에 대한 가장 근접한 조사를 가능하게 한다고 합니다. “수십 종의 영장류와 포유류의 전체 게놈이 알려져 있습니다. 이들의 게놈을 비교하면 어떤 종에 마이크로RNA 회문쌍이 있고 어떤 종이 없는지 알 수 있습니다. 역사에 대한 상세한 모델링을 통해 우리는 단일 돌연변이 사건에 의해 전체 회문이 생성된다는 것을 알 수 있었습니다.” Mönttinen은 말합니다.
헬싱키 연구진은 인간과 다른 영장류에 초점을 맞춰 새로 발견된 메커니즘이 새로운 마이크로RNA 유전자의 최소 4분의 1을 설명할 수 있음을 입증했습니다. 다른 진화 계통에서도 비슷한 사례가 발견되었기 때문에 기원 메커니즘은 보편적인 것으로 보입니다. 원칙적으로 마이크로RNA 유전자의 출현은 매우 쉬워서 새로운 유전자가 인간의 건강에 영향을 미칠 수 있습니다.
-Heli Mönttinen은 예를 들어 생물학적 생명의 기본 원리를 이해하는 등 작업의 중요성을 더 광범위하게 봅니다. "무(無)에서 새로운 유전자의 출현은 연구자들을 매료시켰습니다. 이제 우리는 RNA 유전자의 진화에 대한 우아한 모델을 갖게 되었습니다." 그녀는 강조합니다. 이 결과는 작은 조절 유전자에 기반을 두고 있지만 연구자들은 이 발견이 다른 RNA에도 일반화될 수 있다고 믿습니다 훨씬 더 복잡한 RNA 구조와 기능을 생성할 수 있습니다. 자연 선택를 사용하여 원재료 및 분자. 예를 들어 새로 발견된 메커니즘에 의해 생성된 이 연구는 Proceedings of the National Academy of Sciences게재되었습니다.
추가 정보: Heli A. M. Mönttinen 외, DNA 복제 중 주형 전환을 통한 de novo miRNA 생성, DOI: 10.1073/pnas.2310752120
https://phys.org/news/2023-12-genes.html
댓글