.Three papers highlight results of record 1.3 megajoule yield experiment
http://blog.naver.com/mssoms
http://jl0620.blogspot.com
http://jk0620.tripod.com
https://www.facebook.com/junggoo.lee.9
.Korean scientist who broke Google's nose... "Combining AI to change the game of biotechnology"
구글 콧대 꺾은 한국의 女과학자…"AI 결합해 생명공학 판도 바꿔"

[과학을읽다] 단독인터뷰 - 백민경 전 워싱턴대 박사후 연구원 딥마인드 '알파폴드2' 능가한 로제타폴드 개발 길게는 수년 걸리던 단백질 구조 분석, 수분에 끝내 "융합과학 연구에 과감하고 적극적인 투자 필요" 9월 서울대 생명과학부 조교수 부임 사실도 밝혀 20년 젊어지는 "新물질" 개발한 한국박사 화제! 로또1등 당첨금 "240억 받았습니다" 그 비밀은.. [아시아경제 김봉수 기자]
"과학적 발견의 판도를 바꿨다." 9월 서울대 생명과학부 조교수로 부임하는 백민경(32) 전 미국 워싱턴대 박사후 연구원이 개발한 단백질 구조 예측 인공지능(AI) 프로그램 '로제타폴드(RoseTTAFold)에 대한 평가다. 백 전 연구원은 데이비드 베이커 교수와 함께 구글 자회사 딥마인드가 막대한 컴퓨팅 자원과 인력, 자본을 동원해 만든 같은 종류의 AI 알파폴드2(AlphaFold2)의 성능을 단숨에 능가한 걸작을 만들어 냈다. 세계적 과학전문지 '사이언스(Science)'가 지난해 12월 독자 투표 끝에 올해의 최고 혁신 연구 성과로 뽑힐 정도로 중요한 업적이었다.
백 전 연구원은 아시아경제와의 서면 인터뷰에서 "AI를 통해 단백질 구조를 파악하게 됨으로써 인류의 과학 기술 연구가 한 단계 나아갈 수 있는 기초 토대를 닦았다"고 평가했다. 또 "알파폴드2가 AI와 생명공학을 융합해 획기적인 진전을 이뤄냈듯 현재 학문간 융합연구가 커다란 과학기술 진전의 토대가 되고 있는 만큼 과감한 투자와 안정적인 지원이 필요하다"고 강조하기도 했다.
다음은 백 전 연구원과의 일문 일답.
단백질 구조 예측이 어떤 의미인지.
△단백질은 거의 모든 생명현상에 관여하고 있는 아주 중요한 생체분자다. 예를 들어 시각, 미각, 후각 등 우리가 외부의 자극을 감지하는 과정이나 음식물을 통해 세포가 사용할 에너지를 얻는 과정에도 다양한 단백질이 관여하고 있다. 요즘 코로나 덕분에 좀 더 친숙해진 항체 역시도 면역반응에 관여하는 아주 중요한 단백질 분자다. 외부 자극 감지, 신호전달, 에너지 조달, 면역반응 등 다양한 생명현상을 이해하는 데 굉장히 필수적인 요소다. 단백질이 이렇게 다양한 기능을 가지는 것은 단백질의 서열(아미노산의 조합)에 따라서 서로 다른 구조를 가지고 이에 따른 기능을 수행하기 때문이다. 즉 우리가 단백질의 서열로부터 구조를 손쉽게 알아낼 수 있다면 이 단백질이 어떻게 생명현상에 관여하는지 그 기능을 이해하는 데 아주 큰 도움이 된다. 뿐만 아니라 이를 바탕으로 다양한 치료제, 백신, 플라스틱 분해효소, 바이오센서 개발 등 다양한 분야에 응용할 수 있다.
-그동안에도 단백질 구조 예측은 가능하지 않았나.
△물론 그렇다. 수많은 실험과학자가 단백질의 구조를 실험적으로 밝히기 위해 많은 노력을 쏟아왔다. 하지만 많은 비용과 짧게는 수개월에서 길게는 수년의 시간이 들었다. 이번에 개발된 AI 기반의 단백질 구조 예측방법을 활용하면, 실험을 통한 구조 결정에 드는 비용과 시간을 줄일 수 있다. 더 중요한 생물학적 문제, 혹은 질병치료제 개발 등의 응용 분야에 집중할 수 있게 된다.
-로제타폴드와 알파폴드2의 차이점은.
△그동안 개발돼온 전통적인 계산방식을 어떻게 하면 AI를 활용해서 더욱 그 성능을 개선시키고 효율적으로 만들 수 있을지에 대한 고민이 있었다. 알파폴드2나 로제타폴드 이전의 전통적인 계산방식 중에서 가장 성능이 좋았던 방식엔 단백질의 진화정보를 활용하는 방법이 있었다. 그러다 단백질 서열모음이라는 주어진 데이터 안에 숨어있는 단백질 구조에 대한 패턴을 찾아낼 수만 있다면 단백질의 구조를 잘 예측할 수 있을 것이라는 아이디어가 나왔다. AI가 가장 잘하는 일이 바로 패턴 인식이지 않은가. 이 지점에서 AI가 단백질 구조 예측에 적용됐다. 알파폴드2나 로제타폴드 모두 그동안 자연에 축적돼온 진화 정보를 활용해 단백질의 구조를 예측한다는 점에서 전체적으로는 유사하다. 하지만 이를 구현하는 단계에서 세부적인 알고리즘이 다르다. 로제타폴드의 경우 단백질의 진화정보를 담고 있는 서열모음으로부터 단백질을 구성하는 아미노산 사이의 상호작용에 대한 정보를 얻는 과정에서 직접 3차원 구조를 만들어보고 이에 대한 피드백을 자주 받는다. 알파폴드2의 경우에는 단백질의 3D 구조는 마지막에만 만들어내기 때문에 상대적으로 AI가 만들어진 구조의 피드백을 받는 횟수가 훨씬 적다. 로제타폴드는 단백질의 서열 진화정보와 3D 구조와의 소통을 자주 하도록 설계되었기 때문에 알파폴드2보다 더 효율적으로 구조를 예측할 수 있다.
-향후 의·생명 공학 등 과학기술에 미칠 영향과 과제는.
△신약 개발을 예로 들어 보자. 새로운 약물을 개발할 때 흔히 사용되는 방법 중에 하나가 구조기반의 신약개발 방법이다. 이때 표적 단백질과 신약후보물질이 어떻게 결합할지 그 결합구조를 예측하는 것이 필수적이다. 기존에는 실험적으로 규명된 단백질의 구조가 없다면 구조기반의 신약개발 방법을 활용하기가 어려웠다. 알파폴드2와 같은 단백질 구조 예측 기술이 그동안 구조를 몰랐던 단백질에 대한 고정확도 모델을 제공해줌으로써 실험구조가 없었던 표적단백질에 대해서도 구조기반의 신약개발을 시도할 수 있게 됐다. 그러나 이것이 신약개발 과정에 존재하는 모든 문제를 해결한 것은 아니다. 표적단백질들이 단백질의 활성도에 따라 여러 가지 구조적인 상태를 가지고, 이 중에서 약물이 어떤 특정 상태에만 결합해야 단백질의 활성도를 조절해 약으로써 작용이 가능한 경우들이 많다. 하지만 현재의 단백질 구조 예측 기술은 단백질이 가질 수 있는 다양한 구조 상태를 예측해주고 있지는 못하다.
-단백질의 구조가 약물이 결합하며 살짝 변화하는 경우도 있는데 이런 부분에 대한 예측도 불가능하다. 즉 단순히 단백질의 구조를 아는 것만으로는 충분하지 않고, 이 단백질이 다양한 약물 후보물질들과 어떻게 결합하는지 단백질의 구조 변화까지 고려한 고정확도의 예측과 약물의 결합력과 활성도에 대한 예측이 추가로 필요하다는 얘기다. 앞으로 단백질 구조 예측 기술이 단백질과 다른 분자의 상호작용까지 예측할 수 있다면 우리 실생활에 좀 더 직접적으로 와 닿게 되지 않을까 싶다.
**백민경 박사는? 1990년 광주 출생. 광주과학고ㆍ서울대 화학과(박사) 졸업. 2019년 5~2022년 7월 워싱턴대 박사후연구원으로 근무. 2021년 7월 데이비드 베이커 교수와 함께 단백질 구조 해독 인공지능(AI) 프로그램 '로제타폴드(RoseTTAFold)' 개발. 같은해 12월 국제학술지 '사이언스'로부터 '올해의 최고 혁신 연구'로 선정(한국인 최초). 2022년 9월 서울대 생명과학부 조교수 부임 예정.
=====================
메모 2208101047 나의 사고실험 oms 스토리텔링
새로운 약물에 표적 단백질과 신약후보물질이 어떻게 결합할지 그 결합구조를 예측하는 것이 필수적이다. 그런데 기존에는 실험적으로 규명된 단백질의 구조가 없다면 구조기반의 신약개발 방법을 활용하기가 어려웠다.
인공지능의 역할은 알파폴드2와 같은 단백질 구조 예측 기술이 그동안 구조를 몰랐던 단백질에 대한 고정확도 모델을 제공해줌으로써 실험구조가 없었던 표적단백질에 대해서도 구조기반의 신약개발을 시도할 수 있게 됐다. 그러나 인공지능이 신약개발 과정에 존재하는 모든 문제를 해결한 것은 아니다.
표적단백질들이 단백질의 활성도에 따라 여러 가지 구조적인 상태를 가지고, 이 중에서 약물이 어떤 특정 상태에만 결합해야 단백질의 활성도를 조절해 약으로써 작용이 가능한 경우들이 많다. 하지만 현재의 단백질 구조 예측 기술은 단백질이 가질 수 있는 다양한 구조 상태를 예측해주고 있지는 못하다.
1.
샘플c.oss의 베이스는 표적단백질의 DNA배열과 유사하다. 어떤 배열이 어느 행렬에서 약물작용할 수 있는지 테스팅해준다. 그 다양한 배열을 실험구조가 없이도 효과를 예측할 수 있다. 허허.
Sample a.oms (standard)
b0acfd 0000e0
000ac0 f00bde
0c0fab 000e0d
e00d0c 0b0fa0
f000e0 b0dac0
d0f000 cae0b0
0b000f 0ead0c
0deb00 ac000f
ced0ba 00f000
a0b00e 0dc0f0
0ace00 df000b
0f00d0 e0bc0a
sample b.qoms(standard)
0000000011=2,0
0000001100
0000001100
0000010010
0001100000
0101000000
0010010000
0100100000
2000000000
0010000001
sample b.poms(standard)
p&pp=6n-1(+1)
q0000000000
00q00000000
0000q000000
000000q0000
00000000q00
000000000q
0q000000000
000q0000000
00000q00000
0000000q000
000000000q0
sample c.oss(standard)
zxdxybzyz
zxdzxezxz
xxbyyxzzx
zybzzfxzy
cadccbcdc
cdbdcbdbb
xzezxdyyx
zxezybzyy
bddbcbdca

- What are the future impacts and challenges for science and technology such as medicine and biotechnology?
Take, for example, the development of a new drug. One of the methods commonly used when developing new drugs is the structure-based drug development method. At this time, it is essential to predict the binding structure of how the target protein and the new drug candidate will bind. In the past, if there was no experimentally identified protein structure, it was difficult to utilize the structure-based drug development method. Protein structure prediction technology such as Alphafold 2 provides a high-accuracy model for a protein whose structure has not been known so far, making it possible to try structure-based drug development for target proteins that have no experimental structure. However, this does not solve all the problems that exist in the process of drug development. Target proteins have various structural states depending on the activity of the protein, and there are many cases in which the drug can act as a drug by controlling the activity of the protein only when it binds to a specific state. However, the current protein structure prediction technology does not predict the various structural states that a protein may have.
-There are cases where the structure of a protein changes slightly as a drug binds, and it is impossible to predict such a part. In other words, it is not enough to simply know the structure of a protein, and it is necessary to additionally predict how the protein binds with various drug candidates and the high-accuracy prediction that takes into account the structural change of the protein and the binding force and activity of the drug. I mean. If protein structure prediction technology can predict the interaction of proteins with other molecules in the future, I think it will come into contact with our real life more directly.
=======================
memo 2208101047 my thought experiment oms storytelling
It is essential to predict the binding structure of how a target protein and a new drug candidate will bind to a new drug. However, in the past, it was difficult to utilize the structure-based drug development method if there was no experimentally identified protein structure.
The role of artificial intelligence is that protein structure prediction technology such as Alphafold 2 provides a high-accuracy model for a protein whose structure has not been known so far, so that it is possible to try structure-based drug development even for a target protein that has no experimental structure. However, AI has not solved all the problems that exist in the drug development process.
Target proteins have various structural states depending on the activity of the protein, and there are many cases in which the drug can act as a drug by controlling the activity of the protein only when it binds to a specific state. However, the current protein structure prediction technology does not predict the various structural states that a protein may have.
One.
The base of sample c.oss is similar to the DNA sequence of the target protein. It tests which arrays can act on which matrices. It is possible to predict the effect of the various arrangements without the experimental structure. haha.
Sample a.oms (standard)
b0acfd 0000e0
000ac0 f00bde
0c0fab 000e0d
e00d0c 0b0fa0
f000e0 b0dac0
d0f000 cae0b0
0b000f 0ead0c
0deb00 ac000f
ced0ba 00f000
a0b00e 0dc0f0
0ace00 df000b
0f00d0 e0bc0a
sample b.qoms(standard)
0000000011=2,0
0000001100
0000001100
0000010010
0001100000
0101000000
0010010000
0100100000
2000000000
0010000001
sample b.poms(standard)
p&pp=6n-1(+1)
q0000000000
00q00000000
0000q000000
000000q0000
00000000q00
000000000q
0q000000000
000q0000000
00000q00000
0000000q000
000000000q0
sample c.oss(standard)
zxdxybzyz
zxdzxezxz
xxbyyxzzx
zybzzfxzy
cadccbcdc
cdbdcbdbb
xzezxdyyx
zxezybzyy
bddbcbdca

.Three papers highlight results of record 1.3 megajoule yield experiment
3개의 논문이 기록적인 1.3메가줄 수율 실험의 결과를 강조합니다

Michael Padilla, Lawrence Livermore 국립 연구소 LLNL의 국립 점화 시설(National Ignition Facility)에서 1.3메가줄 이상의 수율을 달성한 지 1년이 되는 날, 이 기록 실험의 과학적 결과는 3개의 동료 검토 논문( Physical Review Letters 에 1개, Physical Review E 에 2개)에 게재되었습니다 . 이 양식화된 이미지는 이러한 기록적인 관성 핵융합 실험에 사용되는 극저온 표적을 보여줍니다. 크레딧: James Wickboldt/LLNL AUGUST 9, 2022
수십 년간의 관성 구속 핵융합 연구 끝에 2021년 8월 8일 로렌스 리버모어 국립 연구소(LLNL)의 국립 점화 시설(NIF)에서 처음으로 1.3메가줄(MJ) 이상의 수율을 달성하여 연구원들을 문턱에 놓았습니다. 융합 이득 및 과학적 점화 달성. 이 역사적인 업적의 1주년을 기념하여 이 기록 실험의 과학적 결과는 3개의 동료 검토 논문( Physical Review Letters 에 1개, Physical Review E 에 2개)으로 발표되었습니다 . 이 중요한 발전을 가능하게 하기 위해 수십 년 동안 노력한 많은 개인을 인정하고 인정하기 위해 1,000명 이상의 저자가 Physical Review Letters 논문 중 하나에 포함되었습니다.
LLNL의 관성 감금 핵융합 프로그램의 수석 과학자인 Omar Hurricane은 "이 기록은 NIF의 실험실에서 핵융합 점화가 가능하다는 것을 입증하는 핵융합 연구 의 주요 과학적 진보였습니다 ."라고 말했습니다. "점화에 필요한 조건을 달성하는 것은 모든 관성 구속 핵융합 연구의 오랜 목표였으며 알파 입자 자체 발열이 핵융합 플라즈마의 모든 냉각 메커니즘을 능가하는 새로운 실험 체제에 대한 액세스를 제공합니다." 이 논문은 2021년 8월 8일의 결과와 관련 설계, 개선 및 실험적 측정에 대해 자세히 설명합니다. LLNL 물리학자이자 실험적인 Physical Review E 논문의 제1저자인 Alex Zylstra는 2020년과 2021년 초에 연구소가 처음으로 "불타는 플라스마" 체제에서 실험을 수행하여 기록적인 촬영의 무대를 마련했다고 언급했습니다.
"그 디자인에서 우리는 2021년 8월 8일 샷을 찍기 위해 몇 가지 개선을 했습니다."라고 그는 말했습니다. "물리적 설계의 개선과 표적의 품질 모두가 Physical Review E 논문 에서 논의된 8월 발사의 성공으로 이어졌습니다 ." 이 실험에는 개선된 표적 설계를 포함하여 몇 가지 변경 사항이 포함되었습니다. 다른 Physical Review E 논문 의 수석 설계자이자 제1저자인 LLNL 물리학자 Annie Kritcher는 "이전 실험에 비해 더 효율적인 홀라움으로 코스팅 시간을 줄이는 것이 연소 플라즈마와 점화 영역 사이를 이동하는 데 핵심이었습니다."라고 말했습니다 . "다른 주요 변경 사항은 개선된 캡슐 품질과 더 작은 연료 주입 튜브입니다."
이 세 부분으로 구성된 이미지는 일부 기능이 표시된 HDC 캡슐을 둘러싸고 있는 금색 열화 우라늄 홀라움을 포함하는 절단된 특징적인 표적 형상(a)을 보여줍니다. ~1cm 높이의 홀라움 중앙에 직경 ~2mm의 캡슐이 부피의 작은 부분을 차지합니다. 레이저 빔은 레이저 입구 구멍이라고 하는 위쪽 및 아래쪽 구멍에서 대상에 들어갑니다. (b)에는 2021년 8월 8일 실험에 대한 총 레이저 출력(파란색) 대 시간 및 시뮬레이션된 홀라움 복사 온도가 표시되어 있으며 몇 가지 핵심 요소가 표시되어 있습니다.
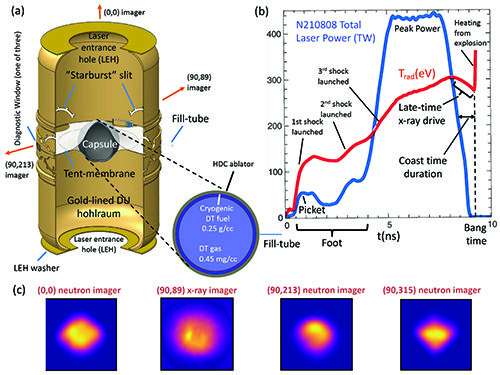
모든 이미지는 100제곱 미크론입니다. 이미징 데이터는 압력 및 기타 플라즈마 속성을 추론하는 데 필요한 핫스팟 플라즈마 볼륨을 재구성하는 데 사용됩니다. 크레딧: 로렌스 리버모어 국립 연구소
지난 8월 실험 이후, 팀은 공연을 반복하고 이 새로운 체제에서 실험적 감도를 이해하기 위해 일련의 실험을 수행했습니다. "많은 변수가 각 실험에 영향을 미칠 수 있습니다."라고 Kritcher는 말했습니다. "192개의 레이저 빔 은 샷마다 정확히 동일하게 작동하지 않으며, 목표물의 품질은 다양하며 얼음 층이 각 목표에서 서로 다른 거칠기로 성장합니다.
이러한 실험은 이 새롭고 민감한 시스템의 고유한 가변성을 테스트하고 이해할 수 있는 기회를 제공했습니다. 실험 체제" 반복 시도는 2021년 8월 실험과 동일한 수준의 핵융합 수율에 도달하지 않았지만, 모두 430-700kJ 범위의 수율로 1보다 큰 캡슐 이득을 보여 이전 최고 수율인 2월 170kJ보다 훨씬 높습니다. 2021. 이러한 실험과 다른 실험을 통해 얻은 데이터는 그 실험을 반복하고 향후 성능을 초과 달성하기 위해 무엇이 옳았고 어떤 변화가 필요한지에 대한 중요한 단서를 제공하고 있습니다.
팀은 또한 실험 데이터를 활용하여 핵융합 점화 및 연소의 기본 과정을 더 깊이 이해하고 비축 관리를 지원하는 시뮬레이션 도구를 향상시킵니다. 앞으로 팀은 축적된 실험 데이터 와 시뮬레이션을 활용하여 이 새로운 실험 체제에서 발견되는 일반적인 경향이 표적 및 레이저 성능의 가변성과 더 잘 분리될 수 있는 더 강력한 영역(점화 절벽 너머)으로 이동하기 위해 노력하고 있습니다. 레이저 개선, 타겟 개선 및 핫스팟 압력을 유지하거나 증가시키면서 핫스팟으로의 에너지 전달을 더욱 개선하는 설계 수정을 통해 핵융합 성능과 견고성을 향상시키기 위한 노력이 진행 중입니다.
여기에는 핵융합 연료의 압축 개선, 연료 및 기타 방법의 양 증가가 포함됩니다. 허리케인은 "실험실 에 발화 의 '존재 증거'가 있다는 것은 매우 흥미로운 일 입니다."라고 말했습니다. "우리는 핵 실험이 끝난 이후로 어떤 연구원도 접근하지 못한 체제에서 운영하고 있으며 우리가 계속 발전하면서 지식을 확장할 수 있는 놀라운 기회입니다."
추가 탐색 국립점화시설에서 핵융합 발화 위기에 처한 연구원들 추가 정보: H. Abu-Shawareb 외, 관성 핵융합 실험에서 초과된 점화에 대한 Lawson 기준, Physical Review Letters (2022). DOI: 10.1103/PhysRevLett.129.075001 AB Zylstra et al, National Ignition Facility에서 점화의 실험적 성과 및 서명, Physical Review E (2022). DOI: 10.1103/PhysRevE.106.025202 AL Kritcher 등, 점화에 대한 Lawson 기준을 초과하는 관성 핵융합 실험 설계, Physical Review E (2022). DOI: 10.1103/PhysRevE.106.025201 저널 정보: Physical Review Letters , Physical Review E 로렌스 리버모어 국립 연구소 제공
====================
메모 2208100759 나의 사고실험 oms 스토리텔링
파워핸들로 거대한 바퀴가 움직이듯 스위칭으로 거대한 기계가 작동되듯이 핵융합의 다양한 점화를 실험실에서 가능하게 만들 수 있다. 이를 실현하는 게 가능한 것인지 다수의 논문이 나왔다. 수십 년간의 관성 구속 핵융합 연구 끝에 처음으로 1.3메가줄(MJ) 이상의 수율을 달성하였다.
실험실에서 핵융합 점화가 가능하다는 것을 입증하는 핵융합 연구 의 주요 과학적 진보이다.
Sample a.oms (standard)
b0acfd 0000e0
000ac0 f00bde
0c0fab 000e0d
e00d0c 0b0fa0
f000e0 b0dac0
d0f000 cae0b0
0b000f 0ead0c
0deb00 ac000f
ced0ba 00f000
a0b00e 0dc0f0
0ace00 df000b
0f00d0 e0bc0a
sample b.qoms(standard)
0000000011=2,0
0000001100
0000001100
0000010010
0001100000
0101000000
0010010000
0100100000
2000000000
0010000001
sample b.poms(standard)
p&pp=6n-1(+1)
q0000000000
00q00000000
0000q000000
000000q0000
00000000q00
000000000q
0q000000000
000q0000000
00000q00000
0000000q000
000000000q0
sample c.oss(standard)
zxdxybzyz
zxdzxezxz
xxbyyxzzx
zybzzfxzy
cadccbcdc
cdbdcbdbb
xzezxdyyx
zxezybzyy
bddbcbdca
댓글